I rifiuti della plastica costituiscono un indicatore delle attività antropogeniche da cui deriva una nuova nicchia ecologica che viene denominata dagli scienziati “plastisfera”.
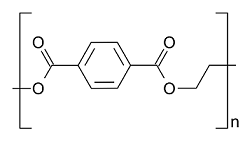
Le sostanze polimeriche che più comunemente vengono rinvenute nei mari sono il polietilene, il polipropilene, il polietilentereftalato, polistirene e il polivinilcloruro derivanti da bottiglie, contenitori, piatti, posate, bicchieri, pellicole, reti da pesca.
Le nazioni che contribuiscono a livello mondiale a inquinare le acque degli oceani con la plastica sono Cina, Filippine, Thailandia, Indonesia e Vietnam mentre il Mediterraneo è maggiormente inquinato dalla Turchia.
Considerando che per smaltire la plastica occorrono da 100 a 1000 anni si comprende che se non si pone un argine allo sversamento in mare di queste sostanze in un tempo non troppo lungo, il mare, che per antonomasia è fonte di vita, diventerà un’enorme pattumiera.
Ciò che è ancora peggio è che i pesci, le tartarughe e le foche possono rimanere impigliati in pezzi di plastica di grosse dimensioni o ingerirli rischiando la vita.
Tuttavia le macroplastiche possono essere intrappolate dagli impianti di trattamento delle acque mentre i frammenti di dimensioni minori possono essere smaltiti da vasche di ossidazione o da fanghi di depurazione pertanto i paesi industrializzati e quindi maggiori produttori di queste sostanze ad alto impatto ambientale potrebbero limitarne o eliminarne lo sversamento.
La macroplastica presente nei mari è quindi dovuta solo all’incuria e alle ferree leggi di mercato che limitano l’adozione di tali supporti tecnologici che eviterebbero lo scempio che si sta compiendo.
L’aspetto ancora più deteriore su cui si stanno concentrando le ricerche è la presenza massiccia nei mari delle microplastiche che costituiscono oltre il 90% della plastica che si trova nel mare: miliardi di microscopici frammenti affondano nelle acque del mare, inquinando l’ambiente marino e alterando l’equilibrio dell’ecosistema.
Le microplastiche che hanno dimensioni che vanno da 4.75 mm a 0.33 mm in aggiunta alle nanoplastiche le cui dimensioni sono inferiori a 100 nm hanno molteplici fonti.
Le microplastiche si suddividono in secondarie derivanti dalla disgregazione e dall’erosione di rifiuti plastici di dimensioni maggiori e in primarie.
Queste ultime sono sicuramente le più preoccupanti in quanto mentre quelle secondarie possono essere limitate sversando in mare una minore quantità di sostanze, le microplastiche primarie derivano da un numero pressoché illimitato di prodotti di uso quotidiano che vanno dai cosmetici come eyeliner e esfolianti ai prodotti per la cura personale quali saponi, shampoo, dentifrici e creme solari, ma anche dal lavaggio di capi di abbigliamento costituiti da fibre sintetiche.
Le microplastiche, a causa delle loro piccolissime dimensioni vengono ingerite da pesci, molluschi e crostacei e da essi giungono nelle nostre tavole.
Se poi si tiene conto che nella produzione industriale delle plastiche sono aggiunte sostanze quali solventi, diluenti, stabilizzanti e plastificanti tra cui bisfenolo A, ftalati e idrocarburi policiclici aromatici l’uomo si trova nel piatto non solo la plastica ma anche tutte quelle sostanze tra cui alcune dichiaratamente tossiche e cancerogene utilizzate per la loro lavorazione che danno fenomeni di bioaccumulo con conseguente crescita esponenziale del rischio.
Tuttavia se l’uomo non sa sfruttare le scoperte scientifiche ma le rivolge a proprio danno per motivi economici, per disinformazione e stupidità non si vede il motivo per il quale gli ignari e inconsapevoli abitanti del mare ne debbano subire le conseguenze: essi infatti subiscono danni fisici spesso irreversibili che colpiscono sia animali di grosse dimensioni ma anche gli invertebrati filtratori che ne rimangono spesso soffocati.
Solo quando l’uomo inizierà ad amare sé stesso e a salvaguardare l’ambiente in cui vive investendo in ricerca questi problemi potranno essere risolti altrimenti dovrà affogare in un mare di plastica